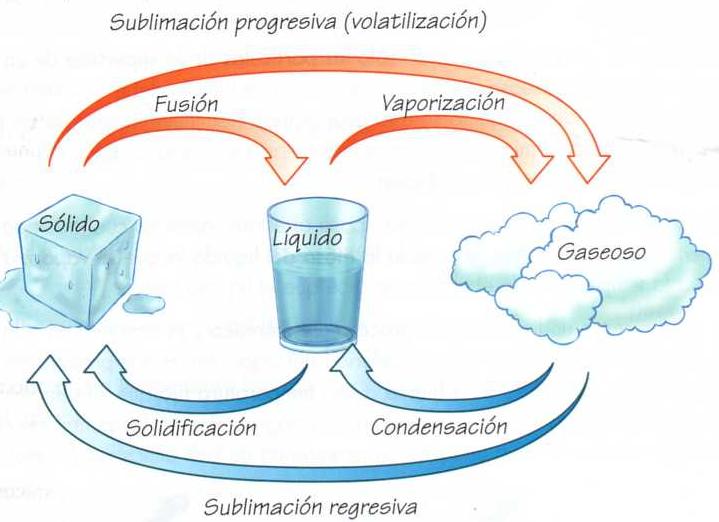
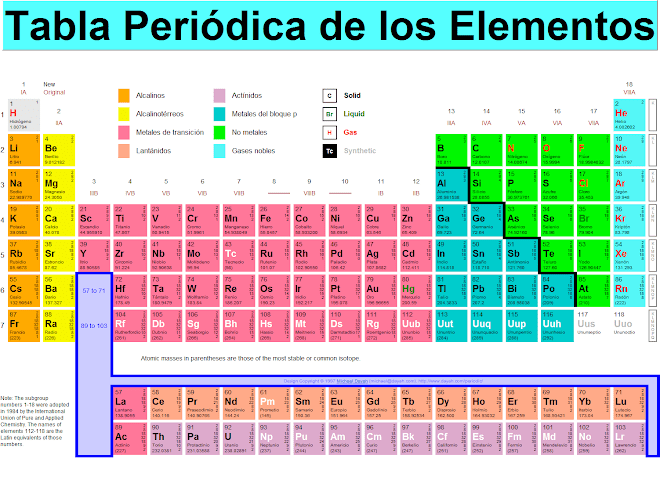
El concepto de átomo como bloque básico e indivisible que compone la materia del universo ya fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
Estructura atómica
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleón, alrededor del cual se encuentra una nube de electrones de carga negativa.
El núcleo atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
* Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 × 10–27 kg y una masa 1837 veces mayor que la del electrón
* Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10–27 kg)
El núcleo más sencillo es el del hidrógeno, formado únicamente por un protón. El núcleo del siguiente elemento en la tabla periódica, el helio, se encuentra formado por dos protones y dos neutrones. La cantidad de protones contenidas en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico. Es el que distingue a un elemento químico de otro. Según lo descrito anteriormente, el número atómico del hidrógeno es 1 (1H), y el del helio, 2 (2He).
La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico. Para los ejemplos dados anteriormente, el número másico del hidrógeno es 1(1H), y el del helio, 4(4He).
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos. Por ejemplo, existen tres isótopos naturales del hidrógeno, el protio (1H), el deuterio (2H) y el tritio (3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden ser diferenciados únicamente por ciertas propiedades físicas.
Otros términos menos utilizados relacionados con la estructura nuclear son los isótonos, que son átomos con el mismo número de neutrones. Los isóbaros son átomos que tienen el mismo número másico.
Debido a que los protones tienen cargas positivas se deberían repeler entre sí, sin embargo, el núcleo del átomo mantiene su cohesión debido a la existencia de otra fuerza de mayor magnitud, aunque de menor alcance conocida como la interacción nuclear fuerte.